高亞威/張勇/高紹榮團隊揭示CTCF在小鼠早期胚胎結合位點動態變化的內在機製,研究成果發表於《基因與發育》
來源🤷🏻:生命科學與技術學院
時間:2024-03-18 瀏覽:
CTCF是一種在哺乳動物中高度保守的DNA結合蛋白,最早作為染色質絕緣子結合蛋白被報道🧑🏽🦰,隨後被發現對於染色質高級結構的調控起到至關重要的作用,參與轉錄激活/抑製🧑🏼🌾、基因印記👱🏽♀️🧍♂️、X染色體失活等重要事件的調節。CTCF通過識別特定的基序結合到染色質上並作為錨點起到固定染色質環的作用👩🏽🚀,是構建染色質三維結構的基礎🧙🏼🛶。過往的研究發現在小鼠胚胎發育早期🐖,染色質的高級結構在囊胚時期的建立完成伴隨著第一次細胞命運決定的發生🧰,並參與細胞從全能性向多能性以及後續分化的調控。CTCF的缺失會導致囊胚發育的異常和胚胎的死亡。但是💁🏿♂️🦻🏽,胚胎早期CTCF結合數據的缺失使得對CTCF在早期胚胎發育過程中作用的研究陷入瓶頸🙍🏼。
3月13日,《基因與發育》(Genes & Development)雜誌在線發表了來自恒达平台生命科學與技術學院高亞威/張勇/高紹榮教授團隊題為“ADNP modulates SINE B2-derived CTCF-binding sites during blastocyst formation in mice”的研究論文。該研究在小鼠中產生了從配子到囊胚過程中CTCF結合位點的動態圖譜🏌🏻,發現了一批衍生出卵裂期特有的CTCF結合位點(cleavage-specific CTCF binding sites, cs-CBSs),探究了cs-CBS產生和消失的內在機製,揭示了其在細胞從全能性向多能性轉換這一過程中的潛在作用。

CTCF對於基因組的識別被認為與結合位點的基序與染色質表觀修飾狀態有關,CTCF結合後會在周圍形成周期性的核小體分布。高紹榮/張勇/高亞威團隊在此前的合作工作利用低起始量的微球菌核酸酶高通量測序(ULI-MNase-seq),首次檢測了小鼠受精後12h內雌雄原核連續時間點的核小體排布模式建立過程,並發現CTCF在受精後3-6小時就已經開始在父源和母源基因組上實現錨定🚵🏼♂️,提示CTCF可能作為胚胎早期染色質調控的重要基礎元件發揮作用♡。為解析植入前胚胎中CTCF建立動態的檢測,合作團隊利用核酸酶靶向切割和釋放(cleavage under target and release using nuclease,CUT&RUN)技術, 獲取了從配子到囊胚過程多個時間點的CTCF結合位點數據,並結合同階段的核小體排布數據以及已發表的表觀數據展開系統研究。團隊確認了CTCF結合位點在減數分裂中消失並在合子基因組之前重新結合的現象,並且發現CTCF基序是CTCF結合位點重新建立主導因素。隨後,研究人員將研究重點放在了第一次細胞命運決定前後,發現了一批在分化後的內細胞團和滋養外胚層中均消失的位點,將其定義為卵裂期特異的CTCF結合位點(cs-CBS)(圖1A)。總結現有發表數據👋,他們發現相較於r-CBS, cs-CBS在胚胎幹細胞中相對各組織器官中具有更高CTCF信號♖,在各種成體組織中🐺,cs-CBS丟失的CTCF信號不會再恢復(圖1B)⏲,提示其可能與細胞多能性狀態存在關聯𓀌👨👩👧👧。進一步分析發現接近80%的cs-CBS由嚙齒類特異的重復序列家族SINE B2衍生而來(圖1C),並且在第一次細胞命運決定前後🏄🏻,cs-CBS上的激活型H3K4me3修飾顯著丟失,抑製型的H3K9me3修飾顯著升高🔇,並伴隨了結合位點轉座子表達活性的顯著下降。
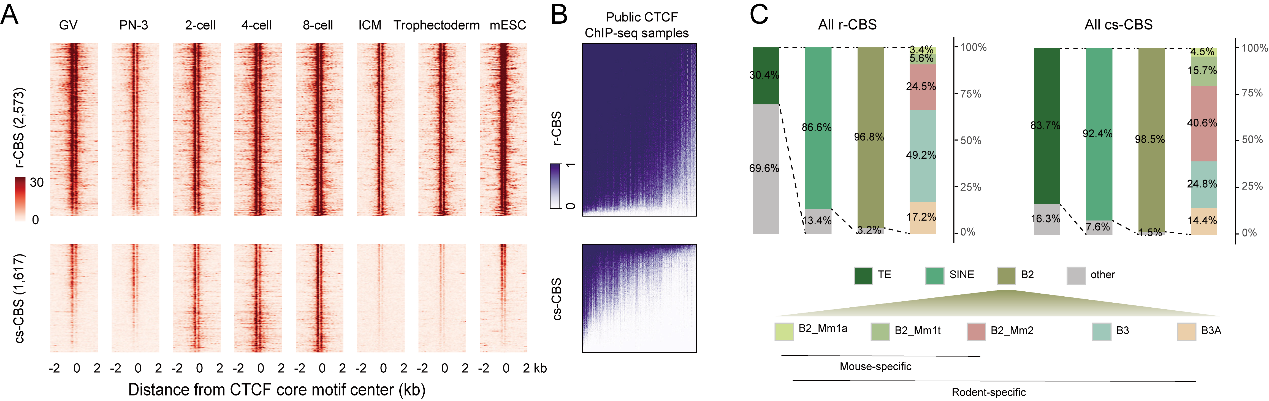
圖1. CTCF結合位點的動態與SINE B2衍生的卵裂期特異的CTCF結合位點
在哺乳動物中轉座子(Transposable elements,TEs)被發現占據了近一半的基因組序列,並呈現高度的物種特異性🐣。根據轉座插入基因組的方式不同,轉座子主要分為逆轉座子和DNA轉座子🧏🏻♂️,逆轉座子可以分為SINE(short interspersed nuclear elements,SINEs)、LINE(long interspersed nuclear elements,LINEs)和LTR(long terminal repeats👩🏻🦲,LTRs)。轉座子序列中往往存在大量的轉錄因子結合位點。在小鼠基因組中🥦🧑✈️,約28% 的CTCF結合位點存在於轉座子序列中,在小鼠胚胎幹細胞中的研究顯示,神經保護蛋白ADNP在SINE B2衍生的CTCF結合位點上同CTCF存在競爭性抑製的關系。通過分析已發表的ADNP結合位點數據,研究人員確認了cs-CBS富集於胚胎幹細胞的ADNP結合區域,提示胚胎發育中cs-CBS可能同樣受到ADNP蛋白的調節。隨後他們利用Crisper-Cas9技術在受精卵中敲除Adnp對於胚胎發育和CTCF結合以及組蛋白修飾等展開檢測❕。他們發現Adnp的敲除會導致囊胚發育異常⚇,內細胞團和滋養外胚層細胞數量的減少⏰,並在著床後的胚胎中引發轉錄組缺陷與細胞凋亡增強,胚胎在E7.5大量死亡。同時他們也發現在敲除後囊胚的cs-CBS上,可以觀察到CTCF結合信號的恢復、H3K9me3修飾信號的下降、H3K4me3修飾信號的輕微回升以及結合位點上SINE B2表達的回升。這些結果都表明ADNP蛋白參與了小鼠囊胚分化過程中CTCF在cs-CBS上的結合活性與表觀修飾改變。
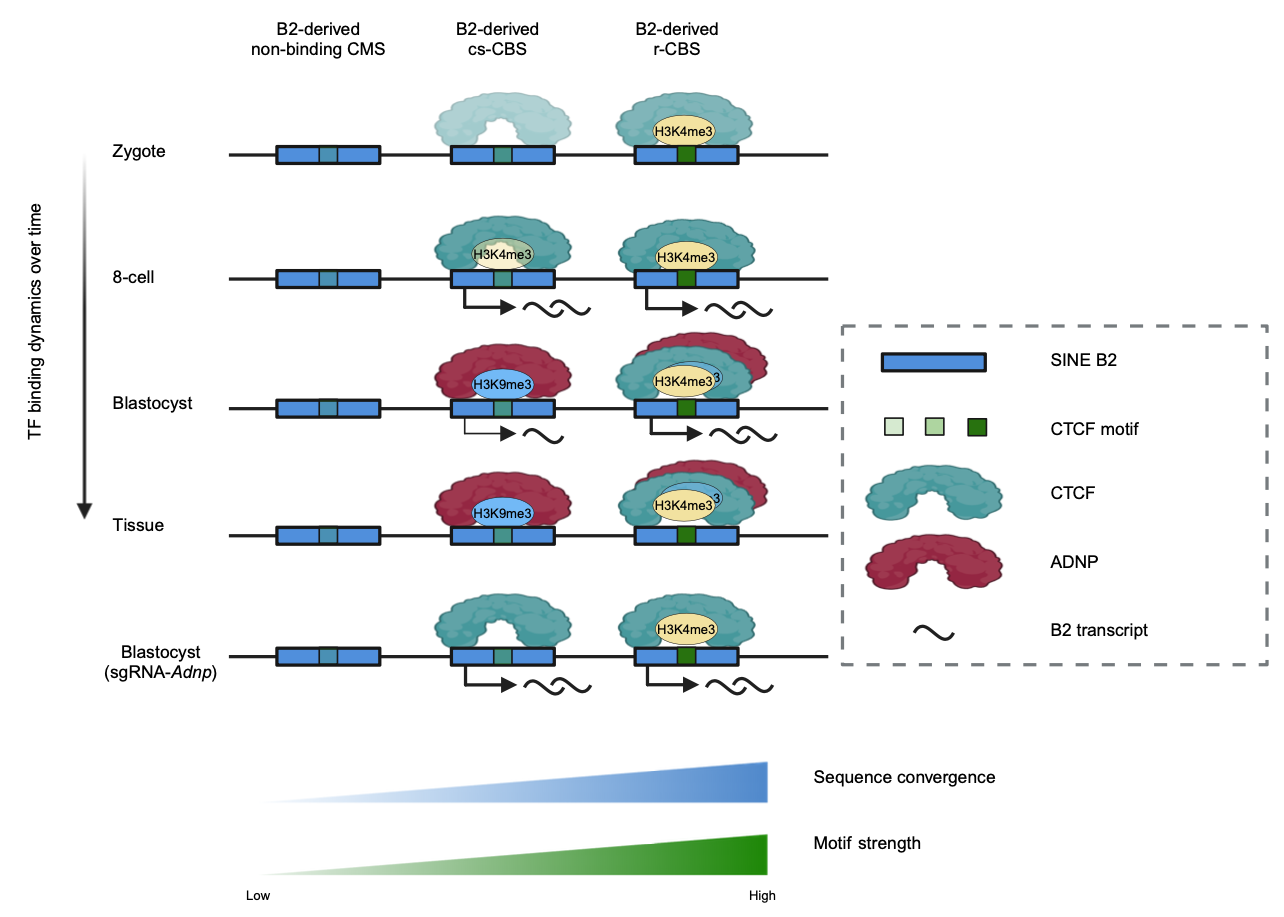
圖2. SINE B2衍生的不同CTCF基序序列在發育過程中的變化情況
進一步的,研究人員發現相較於小鼠胚胎幹細胞,cs-CBS在二細胞樣細胞(two-cell like cells, 2CLC)中具有更高的CTCF結合信號4️⃣。此外,在小鼠胚胎幹細胞通過敲降Adnp可以得到更高比例的MERVL激活型2CLC,提示ADNP對於cs-CBS活性的調控可能與細胞全能性的退出與逆轉座子抑製等過程相關。作者還通過對於重復序列家族SINE B2衍生出的的不同類型CTCF結合位點進行比較🙅🏼,提出了大部分由重復序列衍生的轉錄因子基序進化過程中是一種中型突變這一觀點。
綜上所述⌛️👱🏻,該研究首次繪製了小鼠植入前胚胎的CTCF結合動態🎃🏄🏼♀️,發現了物種特異性轉座子介導的卵裂期特異的CTCF結合特征,發現了囊胚分化過程中ADNP介導的CTCF結合限製。此研究不僅首次解析了CTCF在早期胚胎中的動態模式與調控模型,也進一步擴展了轉座子參與胚胎發育的染色質重塑和轉錄活性調控的可能路徑,在理解轉座子調控發育與基因組進化方面具有重要意義。恒达平台王文博士、高睿副教授、直博生楊東旭、直博生馬明莉為論文的共同第一作者💩,恒达平台高亞威教授、張勇教授👲🏿🫘、高紹榮院士為論文的共同通訊作者💂🏻♀️。
論文鏈接👩🏼🏫:http://doi.org/10.1101/gad.351189.123