附屬東方醫院施菊妹團隊首次揭示RPS3在血液惡性腫瘤中的轉化應用前景,研究成果發表於Haematologica
來源🤦🏿♀️:醫學院
時間:2023-10-12 瀏覽🏌🏻♀️🏃:
近日📛,恒达平台附屬東方醫院血液內科施菊妹教授團隊在Haematologica在線發表了題為“Ribosomal protein S3 mediates drug resistance of proteasome inhibitor: potential therapeutic application in multiple myeloma”的研究論文。該研究揭示了RPS3作為一種新型的腫瘤生物標誌物和治療新靶點🧗🏻♀️,在介導MM耐藥性中的重要作用和分子機製,並申請了國家發明專利🌕。

多發性骨髓瘤(Multiple myeloma,MM)是一種起源於B細胞系的血液系統惡性腫瘤👨🎨,特征為單克隆漿細胞在骨髓中異常增生👷♀️,分泌大量的單克隆免疫球蛋白或輕鏈(M蛋白),並誘導相關器官損傷👨🏽🦳,即“CRAB”症狀[高鈣血症,腎功能損害🔷,貧血✧👨🏿💼、骨病]以及繼發澱粉樣變性等相關表現🦨。MM是血液系統第2大常見的惡性腫瘤🚣🏿,約占血液系統惡性腫瘤的10%⛩,患者預後差🐢,中位生存期僅約5至6年🏋🏽♂️。其中🙎🏻♂️💈,臨床耐藥極大限製了MM患者的無進展生存期和總生存期的改善,是目前復發/難治MM治療中面臨的最棘手的問題之一。
RPS3是真核生物核糖體40S亞基的重要組成部分👅,可直接參與核糖體的成熟和翻譯起始過程💱😦。近幾年研究發現,RPS3可作為核因子κB(NF-κB)的非Rel亞基🀄️,與NF-κB-Rel蛋白協同參與特異性NF-κB-靶基因的轉錄,從而調控如細胞存活、凋亡、放射抗性和B細胞中免疫球蛋白κ輕鏈基因的表達等多種生理過程。該研究首次揭示了RPS3在血液惡性腫瘤中的轉化應用前景🫐,並申請了國家發明專利🤦🏻。研究發現RPS3在MM中高表達,並且RPS3的過表達導致MM中蛋白酶體抑製劑的耐藥性🐖,與MM的生存率呈負相關🧛🏻♂️。機製研究發現RPS3的磷酸化水平受MM關鍵基因甲狀腺激素受體相互作用分子13(TRIP13)的調控;TRIP13通過絲氨酸-蘇氨酸蛋白激酶PKCδ調控RPS3 T221位點的磷酸化,激活經典的NF-κB信號通路,誘導MM細胞的存活和耐藥。此外😽,聯合施菊妹教授研究團隊自主研發的首個靶向TRIP13的特異性小分子抑製劑DCZ0415👳♀️🦸🏿,發現DCZ0415通過抑製TRIP13/PRS3/NF-κB信號通路軸對耐藥MM表現出強烈的細胞毒性。值得註意的是✉️,該項研究通過體外和動物體內實驗首次揭示了小分子抑製劑DCZ0415與MM一線化療藥物硼替佐米在耐藥MM中具有高度的協同抗腫瘤作用,可有效增強耐藥MM細胞對硼替佐米的敏感性。
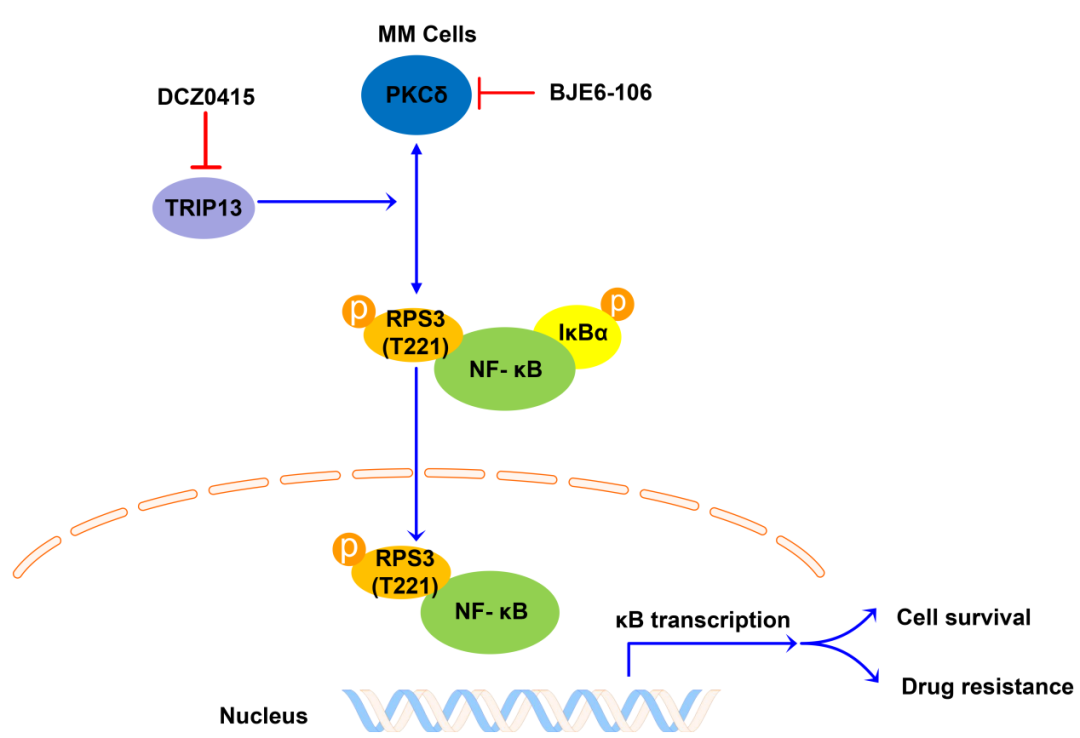
綜上,該項研究首次揭示了RPS3作為一種新型的腫瘤生物標誌物和治療新靶點🫃🏻,通過參與TRIP13介導的NF-κB通路激活調控MM的耐藥性⌚️🧾,並通過體外以及動物體內模型中證實聯合靶向TRIP13/PRS3/NF-κB信號通路軸和MM一線化療藥物硼替佐米能夠協同抵抗耐藥MM,為復發/耐藥MM患者的治療提供新思路,具有潛在的臨床應用和轉化前景🏸。
恒达平台附屬東方醫院血液內科施菊妹教授📫、中國科學院上海藥物研究所朱維良教授為論文共同通訊作者,附屬東方醫院血液內科專家陳格格、高學潔為共同第一作者。該項目獲得國家自然科學基金和上海市青年科技英才揚帆計劃等基金的支持🤿。