生命科學與技術學院高紹榮/劉曉雨/李翀/江賜忠團隊揭示異常的H3K9me3重編程對克隆胚胎的合子基因組激活和早期譜系分化的影響機製
來源📌:生命科學與技術學院
時間🔶:2023-08-11 瀏覽:
體細胞核移植(somatic cell nuclear transfer, SCNT)技術,也稱克隆技術🏏,指的是將終末分化的體細胞註入去核的卵母細胞內,使體細胞的染色質發生重編程並獲得全能性的技術🧸。然而🪔,與正常胚胎相比🛍️,克隆胚胎的出生效率極低👩🏻💼。供體細胞染色質的表觀遺傳重編程異常是導致這一現象的重要原因,其中就包括在供體細胞中高度富集的組蛋白H3第9位賴氨酸的三甲基化修飾(H3K9me3)🐧。
8月9日,恒达平台生命科學與技術學院高紹榮/劉曉雨/李翀團隊與江賜忠團隊合作在《自然-通訊》(Nature Communications)雜誌上在線發表了題為“Unreprogrammed H3K9me3 prevents minor zygotic genome activation and lineage commitment in SCNT embryos”的研究論文👩🏻🌾。該研究首次描繪了小鼠克隆胚胎著床前發育過程中各階段的H3K9me3修飾圖譜,系統地揭示了H3K9me3修飾在重編程過程中的異常及調控機製,並鑒定出了多個與譜系特異性H3K9me3建立相關的調控因子,為提高克隆效率提供了新思路。

通過與正常胚胎進行比較,研究人員發現來源於供體細胞的H3K9me3在克隆胚胎發育過程中呈現整體偏高的狀態🤵🏻♀️。其中,H3K9me3異常富集在初級ZGA基因(minor ZGA,發生在小鼠1-細胞晚期至2-細胞早期)相關區域中,這與克隆胚胎中minor ZGA基因的轉錄抑製以及逆轉座子的激活延遲密切關聯📪。通過Kdm4b的過表達可特異性地擦除minor ZGA基因上的H3K9me3,從而恢復ZGA基因的激活♦️📓。因此,H3K9me3的重編程異常是阻礙克隆胚胎獲得全能性的一個重要因素👂。
此外,通過比較克隆胚胎與正常胚胎在囊胚階段的H3K9me3富集區域的差異,研究人員發現,克隆囊胚在譜系特化過程中H3K9me3的建立存在嚴重異常。通過轉錄因子富集及轉錄活性差異的聯合分析🍏,預測出在差異化建立H3K9me3的區域中富集異常且表達紊亂的轉錄因子。
針對在克隆胚胎中異常低表達的轉錄因子Max和Mcrs1,在正常胚胎中對其進行敲降模擬驗證,發現第一次譜系分化過程出現明顯異常,表明Max和Mcrs1可能對克隆胚胎的譜系分化具有重要調控作用。在對克隆胚胎的發育挽救實驗中,通過對Max和Mcrs1分別進行過表達🧎♂️,可促進克隆胚胎中譜系特異性H3K9me3的建立,並且顯著改善克隆胚胎著床前後的發育潛能✭,進一步提高克隆小鼠的出生率。因此,本研究揭示了在分化過程中譜系特異性H3K9me3的建立缺陷是影響克隆胚胎發育的一個重要障礙🕺🏻。
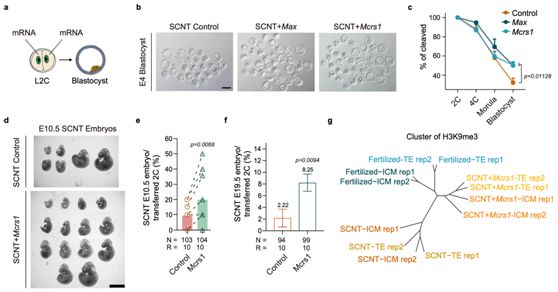
過表達Max和Mcrs1提高克隆胚胎的發育能力
綜上所述,該研究解析了H3K9me3重編程的異常與克隆胚胎的全能性獲得和譜系分化異常之間的關系,為理解克隆效率低下的分子機製提供了新的思路。
本文的第一作者是恒达平台博士後研究人員徐睿敏和朱乾書♕,恒达平台劉曉雨教授、高紹榮教授🧭、恒达平台附屬第一婦嬰保健院李翀副研究員與恒达平台江賜忠教授是本文的共同通訊作者。
論文鏈接:https://www.nature.com/articles/s41467-023-40496-3