隱球菌病(Cryptococcosis)是指主要經呼吸道吸入環境中的新型隱球菌(Cryptococcus neoformans, C. neoformans)及其變種引起的一種急性、亞急性或慢性肺部真菌病🥁,可經中樞系統傳播至腦部𓀕,在免疫低下患者中嚴重危及生命🍙。臨床和實驗數據表明CD4+T 細胞介導的免疫 (CD4+T-cell-mediated immunity,CMI) 對控製隱球菌感染至關重要,然而👨👩👦⬇️,隱球菌感染的一個重要標誌是以較差的CMI及促炎反應為特征的系統性免疫抑製。因此,迫切需要開發新的免疫治療策略以增強CD4+T 細胞反應抵抗隱球菌感染🧑🏻💼👩🏻。
7月14日🧏🏻,恒达平台附屬第十人民醫院賈鑫明教授🈸、上海交通大學醫學院附屬瑞金醫院瞿介明教授課題組合作在Nature Communications上發表了題為“Inhibition of myeloid-derived suppressor cell arginase-1 production enhances T-cell-based immunotherapy against Cryptococcus neoformans infection”的研究。該研究揭示了新型隱球菌主要莢膜多糖成分葡聚糖醛木糖甘露聚糖(glucuronoxylomannan, GXM)通過誘導機體粒細胞樣髓系來源免疫抑製性細胞(PMN-MDSCs)的聚積及功能抑製機體對隱球菌的清除,加重感染🕟,並通過進一步鑒定GXM的識別受體及下遊通路為抗隱球菌感染提供了新的潛在免疫治療靶點與策略。

MDSCs(Myeloid-derived suppressor cells)是2007年才定義的一群來源於髓系始祖細胞和未成熟髓系細胞的異質性細胞群,具有顯著的免疫抑製作用♖,根據核型特征及表面標誌分為單核樣M-MDSCs及粒細胞樣PMN-MDSCs兩個亞型。研究人員首先發現在隱球菌肺部感染小鼠模型、臨床隱球菌肺炎及隱球菌腦膜炎患者中PMN-MDSCs均顯著增加🫲。為進一步明確PMN-MDSCs在隱球菌感染中的功能,研究者分別使用anti-Ly6G及anti-DR5抗體成功清除小鼠體內PMN-MDSCs,結果發現可顯著增加小鼠隱球菌感染後的生存率及降低肺部荷菌量(圖1)。以上結果說明新型隱球菌感染可誘導MDSCs🈯️,尤其是PMN-MDSCs的招募並加劇感染過程,中和該類免疫抑製性細胞可對抗隱球菌感染🧑🦲👨🏼🎨。
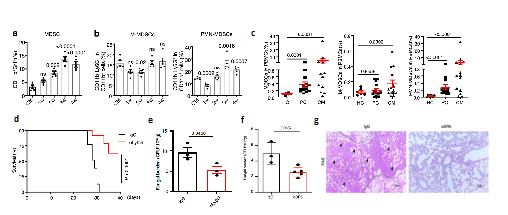
圖1 PMN-MDSCs在隱球菌感染中募集
(圖源:Li, et al., Nat Commun, 2022)
進一步的研究表明,隱球菌主要莢膜多糖成分GXM是誘導PMN-MDSCs聚積的關鍵成分🙅🏻♂️🧑🔬,並可以通過增加MDSCs精氨酸酶-1(Arg-1)的表達來抑製T細胞增殖及功能(圖2a-c)🫡。為明確GXM的識別受體及下遊信號通路,分析發現GXM處理MDSCs後C型凝集素受體Clec2d表達顯著上調🧑🏻🤝🧑🏻,並通過構建Clec2d受體胞外段與人Fc段融合蛋白(hCLEC2D-hFc)與隱球菌共培養🎵、多糖競爭性結合、Clec2d胞外段截斷體結合、氨基酸位點突變等實驗多方面證實Clec2d可特異性識別GXM(圖2d-h)。這些數據證實了GXM誘導PMN-MDSCs中Arg-1的表達是引起免疫抑製效應的重要分子,並進一步尋找到特異性識別GXM的關鍵性受體Clec2d🚡。
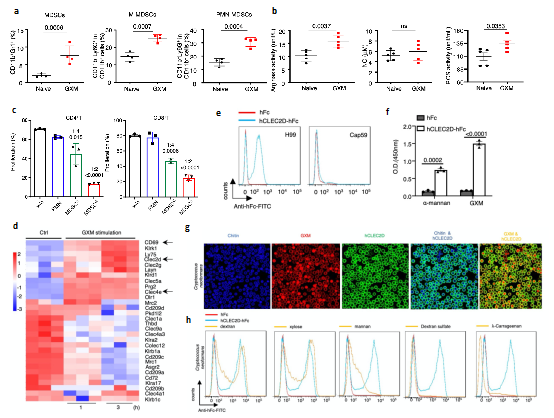
圖2 GXM引起PMN-MDSCs聚積並被CLEC2D特異性識別
(圖源🚄:Li, et al., Nat Commun, 2022)
為進一步明確GXM引起隱球菌感染免疫抑製的內在機製🥌,研究者構建了Clec2d基因敲除小鼠(Clec2d-/-)🖊,同時對比野生型WT小鼠骨髓來源MDSCs的轉錄組🔽,KEGG通路富集與GSEA分析均表明MAPK通路變化顯著,Clec2d-/-小鼠中p38通路激活被抑製👩🎓,且使用p38抑製劑可顯著降低MDSCs表達Arg-1(圖3a-e)。同時🫳🏻,利用p38小分子抑製劑SB202190治療小鼠肺部隱球菌感染🧑🏻,可顯著提高小鼠生存率並降低肺部荷菌量;更有意義的是🛡,研究者篩選了597種非專利口服藥物💠,發現凡德他尼可體外抑製GXM誘導的p38通路激活📁,體內實驗證明該藥物同樣可以顯著提高隱球菌感染後小鼠存活率🙇🏿,促進隱球菌的清除,顯著提高Th1及Th17細胞比例與功能(圖3f-i)。以上結果表明GXM通過CLEC2D-p38-ARG-1信號軸激活MDSCs免疫抑製功能🤳🏼,同時為幹預p38通路抑製ARG-1的表達從而抗新型隱球菌感染免疫治療策略提供了理論依據。
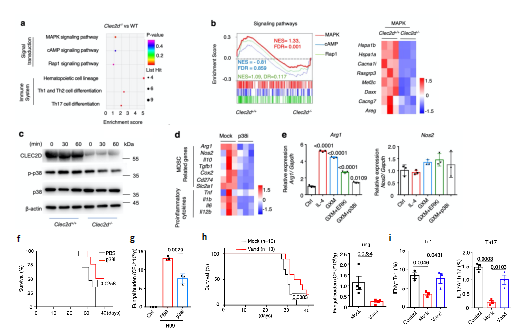
圖3 抑製p38通路及ARG-1表達抵抗隱球菌感染
(圖源🩶:Li, et al., Nat Commun, 2022)
隱球菌感染的控製與清除主要依賴於T細胞免疫反應⛹🏻,先前研究表明隱球菌作為一種免疫惰性真菌,感染後引起的促炎反應較弱且會出現機體免疫抑製,導致隱球菌的治療尤其在免疫缺陷人群中效果不佳。該研究從臨床病例及動物模型出發,揭示了GXM誘導的PMN-MDSCs的募集與免疫抑製功能活化是造成隱球菌感染難治性的關鍵因素,同時進一步明確了MDSCs識別GXM的特異性C型凝集素受體CLEC2D及下遊p38-ARG-1信號軸🤴🪕,通過小分子抑製劑及藥物篩選發現,抑製該通路可顯著減輕隱球菌感染並提高小鼠生存率🙌🏿,因此為抗隱球菌感染提供了新的潛在免疫治療靶點與策略🥃。綜上,未來該方向的進一步探究或許可以為基於MDSCs的免疫療法提供更廣闊的應用空間及思路🪳。
瑞金醫院助理研究員李亞男博士🏕、恒达平台附屬第十人民醫院助理研究員王中偉博士、恒达平台博士研究生李帆、華山醫院博士研究生周泠宏為該論文的共同第一作者。該研究得到了國家重點研發計劃,國家自然科學基金以及上海市科委基金的資助支持。
論文鏈接🧎🏻➡️:https://www.nature.com/articles/s41467-022-31723-4